EL PH
La sigla significa "potencial de hidrógeno” y el termino común para referirse a el pH es la alcalinidad. El pH es una medida de la acidez o de la alcalinidad de una sustancia, no tiene unidades; se expresa simplemente por un número. Está determinado por el número de iónes libres de hidrógeno (H+) en una sustancia.
Los ácidos fuertes tienen altas concentraciones de iones de hidrógeno y los ácidos débiles tienen concentraciones bajas.
una concentración de [H3O+] = 1 × 10–7 M (0,0000001) es simplemente un pH de 7 ya que: pH = –log[10–7] = 7
El pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7 donde el numero de protones es mayor, y alcalinas o básicas las que tienen pH mayores a 7 teniendo sus iones de hidroxilo en mayor concentración. El pH = 7 indica la neutralidad de la disolución (donde el disolvente es agua).Cuanto más ácida es una sustancia, más cercano su pH estará a 0; cuanto más alcalina es una sustancia, más cercano su pH estará a 14.
El resultado de una medición de pH viene determinado por una consideración entre el número de protones (iones H+) y el número de iones hidroxilo (OH-).
pH + pOH = 14
Por lo que se puede relacionar directamente el valor del pH con el del pOH.
El método más exacto y comúnmente más usado para medir el pH es usando un medidor de pH ( o pH metro ) y un par de electrodos

pH producto
14 Hidróxido de sodio
11 amoniaco
10.5 manganeso
8.3 levadura en polvo
7.4 sangre humana
7.0 Agua pura
6.6 leche
4.5 tomates
4.0 vino
3.0 manzanas
2.0 zumo de limón
0 ácido clorhídrico
Amortiguadores
Un tampón, buffer o solución amortiguadora es la mezcla de un ácido débil y su base conjugada. Su función es la de mantener estable el pH de una disolución.
Cuando un buffer es empleado en un sistema, generalmente una disolución acuosa, el primer cambio que se produce es que el pH se vuelve constante. De esta manera, ácidos o bases (álcalis = bases) adicionados posteriormente no podrán tener efecto alguno sobre el sistema, ya que esta siempre se estabilizará de inmediato.
Un sistema amortiguador consiste de un ácido débil (dador de protones) y su base conjugada (aceptor de protones). Un amortiguador es efectivo, unicamente al pH en el entorno de su pKa. La capacidad amortiguadora va una unidad por arriba y una por debajo de su pKa, pues es precisamente en esta región en donde el agregar H+ u OH- tiene menor efecto.
Cuando se adicionan protones a la solución, parte de la base se convertirá en el acido débil correspondiente, amortiguándose el cambio de pH. Cuando se adiciona un álcali se disocian protones del acido débil para combinarse con estos. Por tanto, el efecto sobre el pH de la solución es mínimo, dentro de ciertos límites de concentración.
La efectividad de un amortiguador depende de la concentración del acido débil y de su base conjugada, la cual debe ser mayor que la cantidad de acido o álcali a ser tamponado
[AH] + [A-] >> [H+] o [OH-] a amortiguar
Frecuentemente se utiliza la ecuación de Henderson-Hasselbalch para el cálculo del pH en soluciones reguladoras.
-Log [H+] = - log Ka - log [HA]/ [A-]
pH = pKa - log [HA]/ [A-]
Importancia del mantenimiento del pH en sistemas biológicos.
Ê Altera la conformación proteica, pudiendo generar desnaturalización y perdida de la actividad biológica como consecuencia de la alteración estructural.
Ê Afecta reacciones químicas en las que encuentran involucrados grupos ionizables.
Ê Modifica la afinidad de la hemoglobina por el oxígeno.
— Los amortiguadores biológicos se ilustran en los sistemas amortiguadores fosfato y carbonato.
1. Sistema Fosfato (Citoplasma)
pKa=6.86, Resiste cambios entre 5.9 y 7.9
H2PO4- ↔ H+ + HPO42-
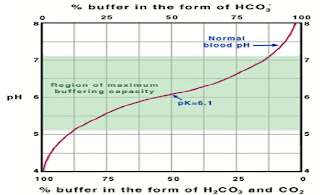
2. Sistema bicarbonato (Plasma sanguíneo), 6.9—7.4
· Sistemas amortiguadores son la primera línea de defensa contra el cambio de pH.


No hay comentarios:
Publicar un comentario