Estructura Atómica
EL átomo se divide en dos partes: el núcleo y la corteza.
 El núcleo es la parte central del átomo, aquí hay partículas con una carga positiva llamadas protones, y también están las partículas de carga neutra, ósea que no contienen una carga eléctrica llamadas neutrones. La masa de los protones es de 1 u.m.a. unidad de masa atómica, y la de un neutrón es aproximadamente igual.
El núcleo es la parte central del átomo, aquí hay partículas con una carga positiva llamadas protones, y también están las partículas de carga neutra, ósea que no contienen una carga eléctrica llamadas neutrones. La masa de los protones es de 1 u.m.a. unidad de masa atómica, y la de un neutrón es aproximadamente igual. La corteza es la parte exterior del átomo, en esta se encuentras las partículas con carga negativas; los electrones. Estos se encuentras situados en distintos niveles de energía girando alrededor del núcleo. La masa atómica de un electrón es unas 1840 veces menor que la de un protón.
Distribución Electrónica
Aunque no podemos saber donde se encuentra un electrón exactamente, ya que están en constante movimiento, sabemos donde esta ubicado energéticamente gracias:
Existen 7 niveles de energía, en estos niveles hay subniveles s, p, d, f, y a su vez en ellos hay una cantidad determinada de orbitales, y cada orbital puede contener como máximo 2 electrones girando en sentidos contrario.
Los Números Cuánticos:
- Principal: Es la cantidad de niveles va del 1 al 7 siendo el 7 el mas exterior
- Azimutal: son los subniveles de energía s, p, d, f.
- Magnético: es el numero de orbital dependiendo el subnivel de energía; en el subnivel s hay un orbital de energía 0, en el subnivel p hay 3 orbitales de energía -1, 0, +1; en el subnivel d hay 5 orbitales de energía -2, -1, 0, +1, +2; en el subnivel f hay 7 orbitales de energía -3, -2, -1, 0, +1, +2, +3
- Spin: Es el sentido en el que gira el electrón en el orbital de energía -1/2, +1/2.

Niveles de energía | 1 | 2 | 3 | 4 |
Subniveles | s | s p | s p d | s p d f |
Número de orbitales de cada tipo | 1 | 1 3 | 1 3 5 | 1 3 5 7 |
Denominación de los orbitales | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
Número máximo de electrones en los orbitales | 2 | 2 - 6 | 2 - 6 - 10 | 2- 6- 10- 14 |
Número máximo de electrones por nivel | 2 | 8 | 18 | 32 |
Hibridación
Se habla de Hibridación cuando en un átomo, se mezcla el orden de los electrones entre orbitales creando una configuración electrónica nueva, cuando hay una combinación de subniveles y se hace una redistribución de energía por partes iguales entre ellos dan origen a orbitales Híbridos.
Hay 3 tipos de Hibridación:
Hay 3 tipos de Hibridación:
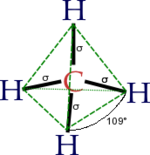
- Tetragonal sp3 es la combinación de los 3 orbitales p y el s realizando 4 orbitales híbridos con igual energía todos ellos.
- Trigonal sp2 es la combinación de 2 orbitales p y el s realizando 3 enlaces con menor energía que el orbital p que quedo puro.
- Digonal sp es la combinación de 1 orbital p y 1 s dando origen a 2 orbitales híbridos y dos puros siendo los puros mas energéticos pero menos fuertes.
-
Enlaces
Un enlace químico es el proceso físico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatónicos y poliatómicos.
Existen 3 tipos de enlaces:
Metálico: Es una especie de nube atómica, ya que hay una transferencia de electrones entre elementos metálicos.
Iónicos: Es la transferencia de un electrón de un elemento poco electronegativo a uno de gran electronegatividad debe existir una decencia mayor o igual a 1.7 de Electronegatividad.
Covalentes: comparten electrones por pares cada elemento aportando 1; y que su electronegatividad sea menor de 1.7
Coordinado o Dativo: uno de los elementos, aporta un par de electrones al enlace.
SÍNTESIS
Cuando deseamos realizarle la distribución electrónica a un átomo, basta con mirar en la tabla su número atómico, pues este representa la cantidad de protones que se encuentra en el núcleo, y como supones que el elemento es neutro tiene la misma cantidad de electrones que de protones. Así luego de realizar la adecuada distribución eléctrica basándonos en los números cuánticos, podemos conocer cual es el nivel de valencia al que se encuentra este elemento y así cuantos electrones puede donar o atraer para completar la regla del octeto. Conociendo su número de valencia y su electronegatividad podemos clasificarlos en los tipos de enlaces, entre estos cabe destacar que pueden ser en los covalente enlaces simples dobles y triples; y polares y no polares. Así con los diferentes en enlaces podemos realizar la molécula de un compuesto específico.
ARTICULO DE REVISTA | |||
Titulo | Autor | URL | Cita Bibliográfica |
“La mecánica cuántica y la descripción del enlace químico.” | Rafael Almeida | Almeida R. La mecánica cuántica y la descripción del enlace químico. Avances en Química2009; 483-90. Disponible en:http://redalyc.uaemex.mx/src/inicio/ArtPdfRed.jsp?iCve=93313204005. Consultado el 28 de agosto de 2010. | |
¿ Cual es la teoría del enlace- valencia y como con ella se pueden interpretar resultados de un función de onda?
¿Cual es la teoría de densidad electrónica y la de átomos en moléculas?


No hay comentarios:
Publicar un comentario